FLUIDOS SUPERCRÍTICOS
Fluidos supercríticos: un fluido supercrítico es cualquier sustancia a una temperatura y presión superiores a su punto crítico. Puede difundirse a través de sólidos como un gas y disolver materiales como un líquido. Además, cerca del punto crítico, pequeños cambios de presión o temperatura dan lugar a grandes cambios de densidad, lo que permite "afinar" muchas propiedades de un fluido supercrítico. Los fluidos supercríticos son adecuados como sustitutos de los disolventes orgánicos en una amplia gama de procesos industriales y de laboratorio. El CO2 es uno de los fluidos supercríticos más utilizados en todo el mundo.
PARA QUÉ SE UTILIZAN LOS
FLUIDOS SUPERCRÍTICOS
Gráficos de fluidos supercríticos
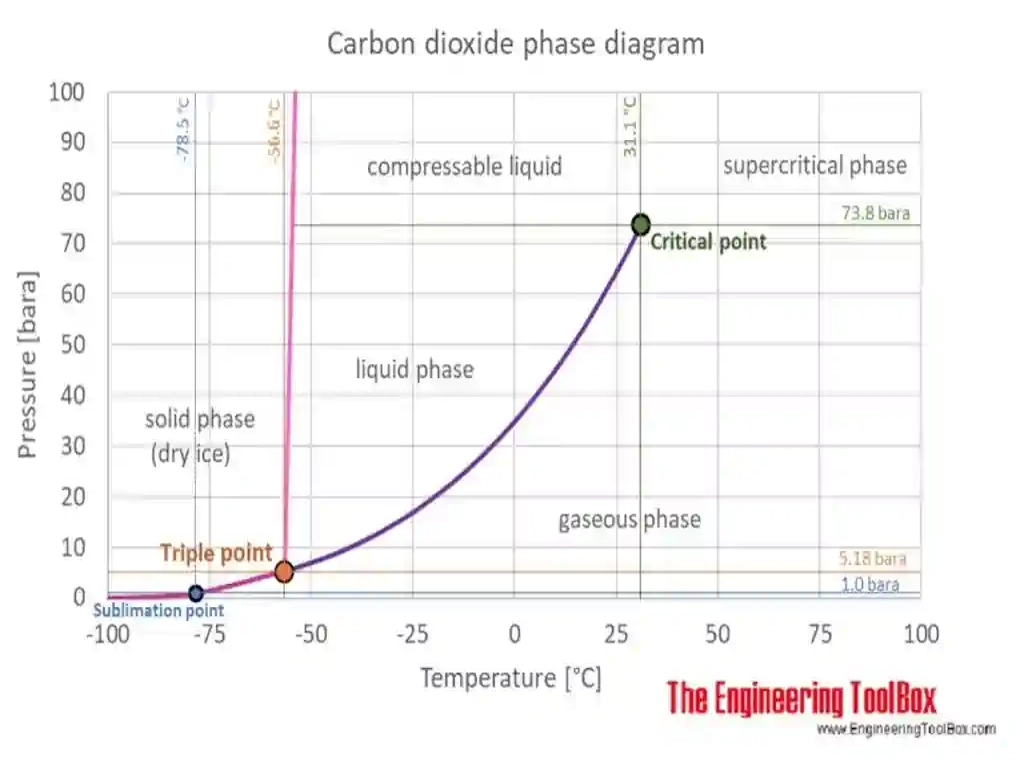
diagrama de fases del co2
Representación de puntos triples y supercríticos
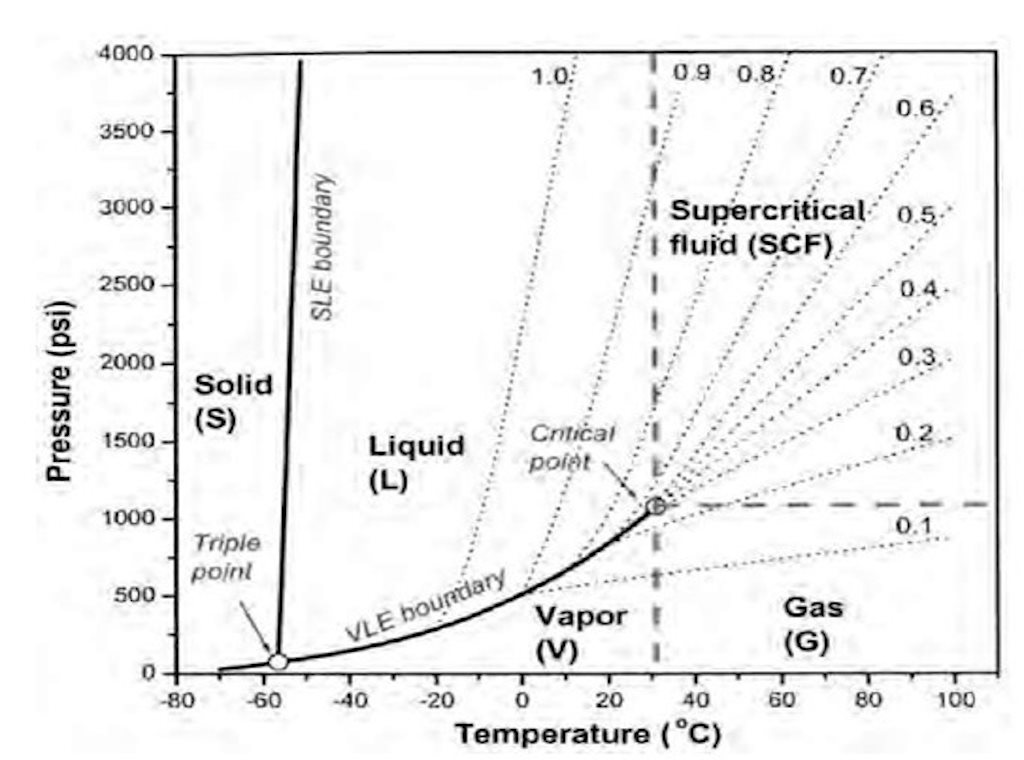
diagrama de densidad
Representación de la densidad al variar la presión y la temperatura.
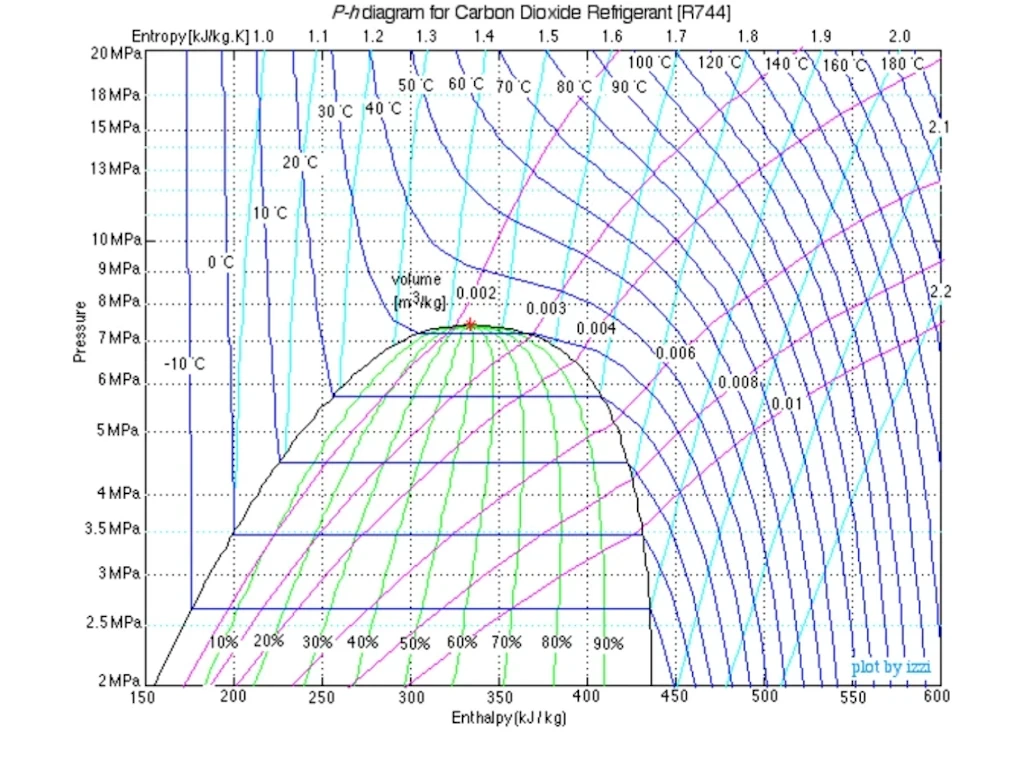
DIAGRAMA DE MOLLIER
Representación de los parámetros termodinámicos.
VENTAJAS DE LOS FLUIDOS SUPERCRÍTICOS: CO2
El CO2 es un fluido supercrítico, el más común entre los fluidos supercríticos, es muy atractivo por muchas razones:
• muy barato y abundante en forma pura (para uso alimentario) en todo el mundo;
• no inflamable y no tóxico;
• respetuoso con el medio ambiente, ya que es un gas no contaminante y la mayor parte del CO2 se produce a partir de corrientes residuales;
• temperatura crítica a 31°C, permitiendo operaciones a temperaturas cercanas a la temperatura ambiente,
• evitar alteraciones del producto;
• presión crítica de 74 bar, lo que conduce a una presión de funcionamiento "aceptable", generalmente entre 100 y 350 bar.
• muy barato y abundante en forma pura (para uso alimentario) en todo el mundo;
• no inflamable y no tóxico;
• respetuoso con el medio ambiente, ya que es un gas no contaminante y la mayor parte del CO2 se produce a partir de corrientes residuales;
• temperatura crítica a 31°C, permitiendo operaciones a temperaturas cercanas a la temperatura ambiente,
• evitar alteraciones del producto;
• presión crítica de 74 bar, lo que conduce a una presión de funcionamiento "aceptable", generalmente entre 100 y 350 bar.
Cosolvente: disolvente orgánico añadido a los principales fluidos supercríticos (generalmente dióxido de carbono) para modificar su poder disolvente hacia moléculas "polares" ya que el propio fluido es capaz de disolver únicamente moléculas "no polares" ; generalmente el codisolvente se elige entre alcoholes, ésteres o cetonas de cadena corta. Por razones obvias, en muchos casos se prefiere el etanol, ya que es abundante y barato en formas puras (para uso alimentario, para farmacopea), poco peligroso para el medio ambiente y poco tóxico, si se utiliza en concentración mínima, del 2% al 5%.
El CO2 está disponible tanto en cilindros o cilindros o paquetes de cilindros de volumen limitado, como a granel en tanques que contienen de 4 a 30 toneladas de gas licuado y no como fluido supercrítico a una presión de 18 bar y a una temperatura alrededor de –18°C. Estos tanques funcionan directamente con camiones criogénicos. El precio es muy sensible a la cantidad entregada, ya que el transporte es el costo principal porque el dióxido de carbono está disponible a un precio muy bajo en varias plantas químicas.
Dado que la mayoría de las plantas SCF requieren dióxido de carbono líquido a una presión de alrededor de 45 bar, el gas licuado debe comprimirse desde la presión de almacenamiento (18 bar) a 50 bar mediante una bomba de transferencia. Para aplicaciones en la industria alimentaria y farmacéutica es obligatorio utilizar una bomba doble membrana para evitar cualquier contaminación por el lubricante de la bomba.




